简介:
细胞凋亡(Apoptosis)是由基因控制的细胞自主的有序性死亡,又称为程序性细胞死亡(Programmed Cell Death),在机体发育、组织稳定等方面起着十分重要的作用。Annexin V/PI双染法是根据凋亡细胞出现细胞膜的不对称性丧失,即磷脂酰丝氨酸(Phosphatidyl serine,PS)由膜内向膜外翻转原理所建立。Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,磷脂酰丝氨酸(Phosphatidylserine,PS)是一种带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使 PS 暴露在细胞膜外。Annexin V具有易于结合到磷脂类如PS的特性,对 PS 有高度的亲和性。能与细胞凋亡过程中翻转到膜外的磷脂酰丝氨酸PS高亲和力特异性结合。Annexin V 是检测早期细胞凋亡的最灵敏指标之一,以标记了FITC的Annexin V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。 Propidium iodide(PI)是一种核酸染料,它不能透过完整的细胞膜,但凋亡中晚期和死细胞由于细胞膜破裂,因此 PI 能够将细胞核染红。将AnnexinV与PI匹配使用,若横坐标表示Annexin V信号,纵坐标表示PI信号,则左下象限 (Annexin V-/PI-) 代表活细胞;右下象限(Annexin V+ /PI-) 代表早期凋亡细胞;右上象限(Annexin V+ /PI+)代表凋亡晚期细胞和坏死细胞;左上象限(Annexin V-/PI+) 被认为是许可范围内的检测误差。
本试剂盒使用改进型的高纯度FITC染料,其在红色通道(690nm)无发射光,因此极大的减少了对红色通道的干扰。使用该试剂盒进行细胞凋亡检测时荧光相互干扰更小、检测更准确。
操作步骤:
1. 贴壁细胞:用胰酶消化至单细胞悬液; 悬浮细胞:可直接使用。
2. 1000 rpm(400g),离心 5 min,弃上清。
3. 加入 1 ml PBS,轻轻吹打使细胞悬浮,1000rpm,离心5 min,弃上清。
4. 再重复步骤 3 一次,尽可能吸除多余的PBS溶液;
5. 加入 1× Annexin V Binding Buffer 重悬细胞,使细胞密度为 0.2-1×106个/ml。
注意:a.必须使用 1× Annexin V Binding Buffer 重悬细胞(不可使用 PBS 重悬,否则会导致Annexin V 无法结合PS位点);
b.将细胞悬液用200 目筛网过滤一次,再进行下述操作将有助于获得最佳试验结果。
6. 取100 μl上述细胞重悬液,加入 5 μl Annexin V-FITC、5 μl PI Staining Solution混合均匀,室温避光放置15 min。
7. 反应结束后加400 μl Binding Buffer轻轻混匀在1小时内上流式细胞仪检测。
注意:a. 流式细胞仪要求配备488 nm激发光源;FITC使用绿色通道检测(525 nm);PI推荐使用红色通道检测(690 nm), PI也可使用黄色通道检测(580 nm),但黄色通道必须进行荧光补偿操作。
b. 本试剂采用高纯度改进型 FITC染料,其无法在红色通道检测,因此采用绿色通道和红色通道进行检测时,通常无需荧光补偿操作。
8. 若用荧光显微镜检测,将细胞混合液离心,取细胞沉淀涂片,再进行观察。
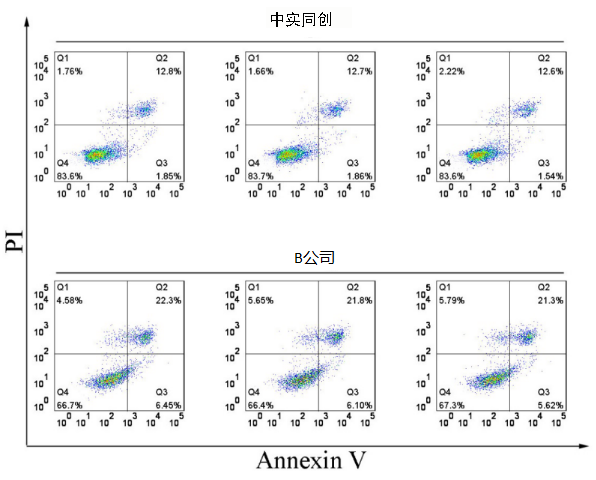
Fig 1.处理好的乳腺癌MDA-MB-231细胞用Annexin V和PI (各5μl)在室温下避光染色15 min,再进行BD流式细胞分析,通过Flow Jo分析数据。
注意事项:
1. 整个操作过程动作要尽量轻柔,勿用力吹打细胞。
2. 反应完毕后请尽快检测,反应1小时后荧光强度就开始衰变。
3. Annexin V-FITC和Propidium iodide是光敏物质,在操作时请注意避光。
4. 试验操作过程中佩戴手套等防护用品。
5. 试验开始前将一定量的10× Annexin V Binding Buffer用超纯水(1:9)稀释至1×备用。
6.注意避免反复冻融
7.如果有细菌或真菌污染,会严重影响检测效果。
8.如果细胞收集过程中使用了胰酶,需注意设法去除残留的胰酶。残留的胰酶会消化并降解Annexin V-FITC,导致染色失败。
9.用于流式细胞仪检测时,如果发现Annexin V-FITC单独染色时出现了过多的PI假阳性细胞,并且通过调整相关设置和参数也 无法改善,可以用PBS将Annexin V-FITC稀释3-10倍后再进行检测,这样通常可以有效减少假阳性的坏死细胞。
储存:
2-8℃,有效期1年。
相关产品: