简介:
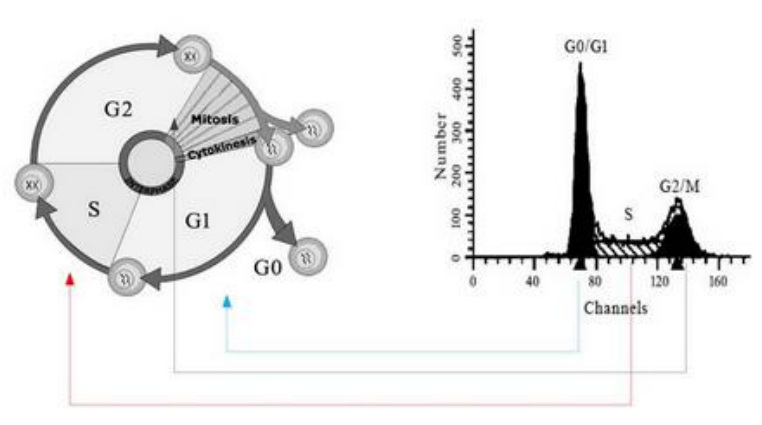
细胞周期(cell cycle)是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,由细胞周期素(Cyclin)依次激活相应的细胞周期蛋白依赖激酶(CDK)所推动。XDK周期性积累与分解对细胞周期进展起着正调控作用,而细胞周期蛋白依赖性激酶抑制因子(CKI)通过在细胞周期适当的时间点上抑制CDK的活性,从而对细胞周期进展起负调控作用。细胞周期又可以分为间期(interphase)和有丝分裂期(M phase),细胞间期又常划分为休眠期(G0),DNA合成前期(G1),DNA合成期(S),DNA合成后期(G2),整个周期可表示为G1→S→G2→M。DNA 周期检测可用来反应细胞周期的各个期的状况,即细胞增殖状况。
采用经典的碘化丙啶染色(Propidium staining,即PI staining)方法进行细胞周期与细胞凋亡分析,利用细胞内 DNA能够和荧光染料(如碘化丙啶--PI)结合的特性,细胞各个时期其DNA含量不同从而结合的荧光染料不同,流式细胞仪检测的荧光强度也不一样(如下图所示)。碘化丙啶染色后,假设G0/G1期细胞的荧光强度为1,那么含有双份基因组DNA的G2/M期细胞的荧光强度的理论值为2,正在进行DNA复制的S期细胞的荧光强度为1-2之间。凋亡细胞由于细胞核发生浓缩以及发生DNA片段化(DNA fragmentation)导致部分基因组DNA片段在染色过程中丢失,因此凋亡细胞碘化丙啶染色后呈现明显的弱染,即荧光强度小于1,在流式检测的荧光图上出现所谓的sub-G1峰,即凋亡细胞峰。
PI-DNA 复合物的最大激发波长为535nm,最大发射波长为615nm,PI 的红色荧光在FL2或FL3通道检测(通常检测通道为:488nm 激发;583nm检测)。每个样采集20000~30000events。本试剂盒经过优化的配方,可获得绝佳的周期结果,可应用于培养细胞(悬浮、贴壁)的 DNA 含量(细胞周期)检测。
操作步骤:
1. 细胞周期检测需要细胞量大,通常使用6孔板以上的培养器皿进行检测(视细胞密度,约 1×106 个 cells)。
贴壁细胞:从培养板中将培养基吸除,PBS溶液清洗3次,加入200 μl胰酶消化至单细胞悬液(可轻轻吹打),加入1 ml PBS终止消化,吹打细胞成单细胞悬液。悬浮细胞:可直接离心进行后续操作。
2. 2000 rpm(300g),离心10 min,弃上清(采用吸取方式,防止细胞丢失)。
3. 加入1 ml PBS,轻轻吹打使细胞悬浮,2000 rpm(300g),离心10 min,弃上清(采用吸取方式,防止细胞丢失)。
4. 加入500 μl PBS重悬细胞,吹打细胞至单细胞悬液。将细胞逐滴加入到10 ml冰冷75%乙醇中(事先冻存于-20℃),旋涡混合仪上迅速混合均匀,4℃固定>2h(通常过夜),固定的细胞可于-20℃保存 1 个月。
5. 2000 rpm(300g),离心10 min,完全弃上清(采用吸取方式,防止细胞丢失),用 200 μl吸头尽可能多的吸除残留乙醇。
6.直接使用0.5 ml PI Staining Buffer(确认已经加入Rnase A)重悬细胞,使用 PI Staining Buffer 调整细胞浓度至 0.5~1×106个/ml。
7.室温避光孵育15-20 min后进行检测(细胞孵育时间不要超过 1h)。
8. 使用FL2通道检测,收集20000~30000 events。FL2使用Lin参数收集信号,FL2-W/FL2-A,进行圈门排除粘连体细胞。试验结束后,使用Flowjo或ModFit软件进行拟和数据分析。通常使用该试剂盒可以获得绝佳的结果(CV极小)。
试剂盒 自配试剂
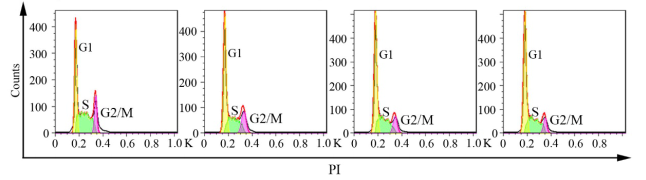
Fig1.比较Superbrilliant® Cell Cycle Detection Kit和自配试剂。自配试剂将细胞在37℃下用0.025 mg / mL的碘化丙啶 (PI) 在避光染色0.5小时。然后用BD FACS Calibur流式细胞仪 (BD,Franklin Lakes, NJ) , Cell Quest和MODFIT计算机程序 (BD) 进行分析。
注意事项:
自备75%乙醇
储存:
(1)首次使用前将Rnase A全部加到PI Staining Buffer中混合均匀 2-8℃可保存6个月。
(2) 2-8℃,有效期 2年。
相关产品: